Sự điện li là gì? Cách nào để phân biệt được các chất điện li yếu và điện li mạnh? Nếu bạn đang tìm hiểu về những khái niệm này, hãy tiếp tục đọc bài viết bên dưới của Top Xuyên Việt để chúng ta cùng làm rõ lý thuyết cũng như thực hành các dạng bài tập sự điện li.
1. Sự điện li là gì?
Quá trình phân li của các chất trong nước được gọi là sự điện li (hoặc khi nóng chảy). Các cation (ion dương) và anion (ion âm) được tách ra từ các phân tử chất điện li chính là sản phẩm của quá trình điện li. Các ion này cũng đồng thời là nguyên nhân sinh ra khả năng dẫn điện của dung dịch.
Những chất điện li là những chất tan trong nước (hoặc nóng chảy) phân li ra ion. Hoặc nói về định nghĩa hẹp hơn, các dung dịch dẫn được điện là chất điện li. Chất điện li không thể là các nguyên tố mà có thể là các hợp chất hóa học. Ví dụ như bazo, axit và muối là các chất điện li.
* Chất điện li có tính chất tan được trong nước.
Trong dung dịch, các hợp chất hóa học như muối, axit và bazo bị phân li (một phần hay toàn bộ) thành các nguyên tử (hay nhóm nguyên tử) tích điện có tên là ion. Trong dung dịch, ion có thể chuyển động tự do và trở thành hạt tải điện.
Một số hợp chất có sự phân li như sau:
- Axit → gốc axit (ion âm) + H+ .
- Bazo → OH– (ion âm) + ion dương (kim loại).
- Muối → gốc axit (ion âm) + ion dương (kim loại).
Một số bazo bị phân li thành ion trong dung dịch mặc dù không chứa ion kim loại. Cation và Anion là phần mang điện dương của phân tử.

Sự điện li là gì?
2. Làm thế nào để phân loại các chất điện li
- Chất điện li mạnh: Đây là chất mà khi những phân tử hòa tan trong nước đều được phân li ra ion. Chất điện li mạnh đều là các axit mạnh như HCI, HNO3, HClO4, H2SO4,… hay một số bazo mạnh như NaOH, KOH,… và đa phần là các loại muối.
- Chất điện li yếu: Khi tan trong nước, những chất này chỉ có một số ít phân tử hòa tan có thể phân li ra ion. Phần còn lại vẫn ở dưới dạng phân tử trong dung dịch. Ví dụ về chất điện li yếu như HClO, axit H2SO3, H2S, CH3COOH,… hoặc một số bazo yếu như Mg(OH)2, Bi(OH)3,…

Chất điện li gồm có chất điện li mạnh và yếu
3. Tại sao các dung dịch axit, bazo và muối lại dẫn điện?
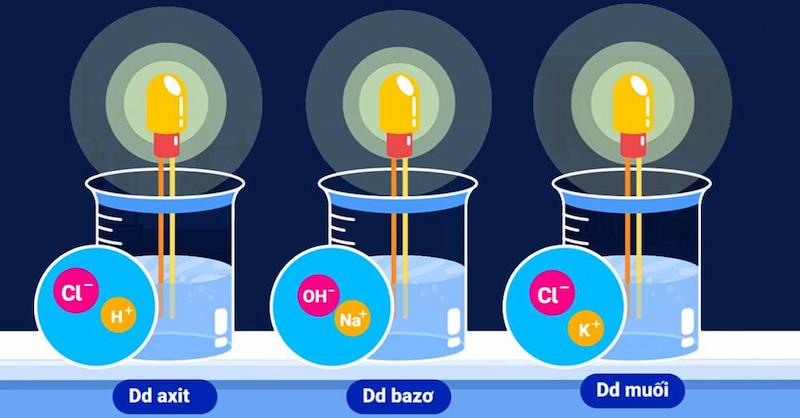
Năm 1887, qua thực nghiệm A-rê-ni-ut kết luận rằng: Vì trong dung dịch, các axit, bazo và muối chứa các tiểu phân mang điện tích chuyển động tự do, còn gọi là các ion (bao gồm anion và cation) nên chúng có khả năng dẫn điện.
Cụ thể, do nguyên tử oxi có độ âm điện lớn hơn nguyên tử hydro nên phân tử nước bị phân cực thành hai đầu âm và dương. Do đó, sẽ làm lệch cặp electron về phía oxi. Vì vậy, phân tử của nó sẽ bị bao bọc và tương tác với phân tử nước khi một chất có liên kết ion hay liên kết cộng hóa trị phân cực hòa tan trong nước. Lúc này chúng sẽ tách các chất này ra thành các ion. Trong đó ion âm (-) được tách ra bởi nguyên tử hydro (mang điện dương) và ion dương (+) bởi nguyên tử oxi (mang điện âm). Vì bị phá vỡ liên kết các nguyên tử nên xảy ra quá trình giải phóng năng lượng.
Trong khi đó, trong dung dịch các chất như đường saccarozơ, glixerol, ancol etylic không thể dẫn điện vì chúng không phân li ra các ion dương và âm. Lý do bởi vì trong phân tử có liên kết phân cực nhưng rất yếu.
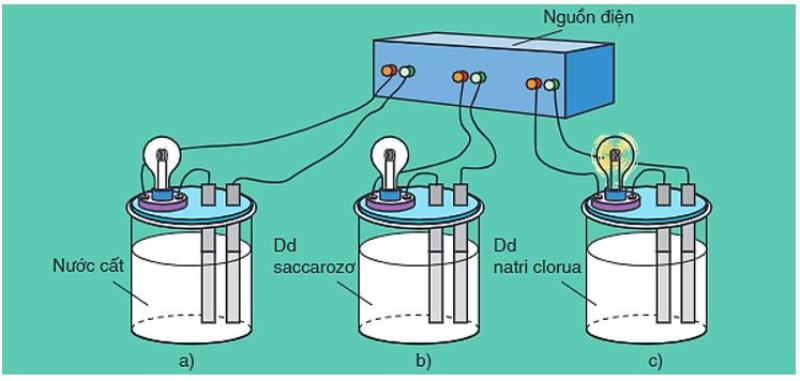
Các dung dịch axit, bazo và muối có khả năng dẫn điện
4. Các bài tập sự điện li nâng cao tham khảo
Bài 1 (Trang 7 SGK Hóa 11)
Nguyên nhân nào mà các dung dịch như ancol etylic, saccarozơ, glixerol không dẫn điện trong khi các dung dịch axit như HCl, bazơ như NaOH và muối như NaCl dẫn điện được?
Đáp án:
Trong dung dịch: Các bazo, axit và muối phân li ra các ion âm và ion dương chuyển động tự do nên dung dịch của chúng có khả năng dẫn điện.
Ví dụ :
HCl → H+ + Cl-
NaOH → Na+ + OH-
NaCl → Na+ + Cl-
Còn các dung dịch như đường saccarozơ, ancol etylic, glixerol không dẫn điện vì chúng không phân li ra các ion âm và ion dương trong dung dịch.
Các dạng bài tập về sự điện li
Bài 2 (Trang 7 SGK Hóa 11)
Khái niệm chi tiết về sự điện li, chất điện li? Chất điện li là những loại chất nào? Thế nào là chất điện li yếu, chất điện li mạnh? Lấy ví dụ minh họa và nêu ra phương trình điện li của chúng?
Đáp án:
- Sự phân li thành các anion (ion âm) và cation (ion dương) của phân tử chất điện li khi tan trong nước được gọi là sự điện li.
- Những chất tan trong nước và tạo thành dung dịch dẫn điện gọi là chất điện li.
- Các chất là chất điện li như các bazo, axit và các muối tan được trong nước.
- Những chất khi tan trong nước các phân tử hoà tan đều phân li ra ion được gọi là chất điện li mạnh. Ví dụ:
H2SO4 → 2H+ + SO4(2-)
KOH → K+ + OH-
Na2SO4 → 2Na+ + SO42-
- Chỉ có một phần số phân tử hoà tan phân ra ion trong số những chất khi tan trong nước gọi là chất điện li yếu và phần còn tồn tại dưới dạng phân tử trong dung dịch.
Ví dụ: H2S ⇌ H+ + HS-
Như vậy, bài viết của Top Xuyên Việt đã giúp bạn hiểu rõ hơn về sự điện li. Hy vọng các thông tin đã thực sự hữu ích cho bạn trong học tập và đời sống.
Xem thêm:





